Resolução UEM-2014 verão (prova 1) - conhecimentos gerais
19) Sobre a poluição do ar, assinale o que for correto.
01) Falsa.
Na baixa atmosfera o ozônio é poluente.
02) Falsa.
A absorção de calor pelas moléculas é o efeito estufa.
04) Verdadeira.
O monóxido de carbono é um gás tóxico liberado pelos automóveis, que, combinado
com a hemoglobina do sangue, inutiliza-a para o transporte de oxigênio.
08) Verdadeira.
As partículas inaláveis, como a sílica (SiO2), encontradas nas fábricas
de cimento, quando em suspensão no ar, causam doenças pulmonares, como fibroses
e enfisemas.
16) Verdadeira.
A chuva ácida é resultante da reação de SO2 e de NO2 com
gases e água na atmosfera, gerando H2SO4 e HNO3.
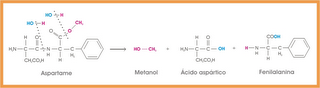
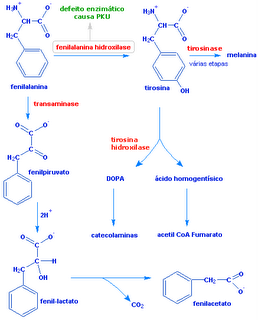
20) Pesquisas
científicas mostram que sentimentos como amor e paixão entre duas pessoas
resultam de complexas reações químicas que acontecem no cérebro. Essas reações,
em suma, ocorrem por meio de três substâncias, a dopamina, a noraepinefrina (ou
noradrenalina) e a serotonina. O aumento dos níveis de dopamina causa excitação
e alegria, enquanto que a perda de sono experimentada pelos apaixonados está
ligada à diminuição dos níveis de serotonina. Com base nas estruturas químicas
dessas substâncias e de aminoácidos em geral, e no conhecimento do
funcionamento do sistema nervoso central humano, assinale a(s) alternativa(s)
correta(s).
01) Verdadeira.
A noraepinefrina é produzida na medula adrenal a partir da tirosina, sendo que
este aminoácido apresenta a função fenol.
02) Verdadeira.
As três substâncias descritas são neurotransmissoras, responsáveis por sinapses
químicas no cérebro.
04) Verdadeira.
As três substâncias descritas apresentam funções químicas que se comportam como
ácido ou como base de Arrhenius em solução aquosa.
08) Falsa.
A dopamina e a serotonina não apresentam carbono assimétrico ou quiral.
16) Falsa.
Isômeros ópticos são fisiologicamente diferentes.
25) O
pH (potencial hidrogeniônico) de soluções aquosas é dado pela expressão pH =
-log[H+], onde [H+]
indica a concentração em mol/litro de íons H+ nessa solução. O
quadro abaixo fornece o pH aproximado de algumas bebidas do nosso dia a dia.
Com
base nessa tabela e nos conhecimentos de Química, assinale o que for correto.
01) Falsa.
Quanto menor o pH, maior a concentração de H+ .
02) Verdadeira.
Quanto maior for a concentração de íons H+, mais ácida será a
bebida.
04) Verdadeira.
Em um litro de leite a concentração H+ é de aproximadamente 10-6,5
pH=- log 10-6,5
pH=6,5
08) Verdadeira.
Na diluição: 200 . 10-3 = X . (200+100)
[ H+ ] = 0,66 .10-3 mol/L
pH = 3,18
16) Falsa.
[ H+ ] = 0,66 .10-3 mol/L
pH = 3,18
16) Falsa.
A diluição diminui a concentração do íon H+
26) Sabendo-se
que a ligação química covalente estabelecida entre dois átomos diferentes gera
um momento de dipolo não nulo, assinale a(s) alternativa(s) correta(s) a
respeito da polaridade e do vetor momento de dipolo em moléculas.
01) Falsa.
A molécula de água é polar e o dióxido de carbono é apolar.
02) Verdadeira.
As moléculas de eteno e etino apresentam momento de dipolo não nulo na ligação
entre os átomos de carbono e de hidrogênio. Hidrocarbonetos são moléculas apolares.
04) Falsa.
O tetracloreto de carbono é apolar.
08) Falsa.
Toda molécula trigonal plana que apresenta 3 vetores de momento de dipolo,
dispostos em um plano, com ângulo de 120° entre eles, é uma molécula apolar, caso os átomos ligados ao átomo central sejam iguais.
16) Verdadeira.
Numa molécula octaédrica do tipo MA2B2C2, onde
M é o átomo central, e A, B e C são átomos ligados a M, pode-se dizer que a
molécula será apolar se, e somente se, todas as ligações forem feitas entre M e
dois átomos iguais diametralmente opostos,ocorrendo assim, o cancelamento dos vetores campo elétrico das ligações.
27) Assinale
a(s) alternativa(s) correta(s) relacionada(s) com as fontes de poluição e de contaminação
de rios, em áreas urbanas e rurais, e com as formas de tratamento dessa
água.
01) Verdadeira.
Em áreas urbanas, uma das fontes de poluição dos rios é o despejo de resíduos
de sabão e de detergente. No decorrer do tempo, os resíduos de sabão são decompostos,
pois são biodegradáveis. Já os resíduos de detergente podem ser ou não
biodegradáveis, dependendo do tipo de cadeia carbônica.Os detergentes de cadeia normal são biodegradáveis e os de cadeia ramificada não são.
02) Falsa.
Os rios que recebem as
águas das chuvas não ficam protegidos da contaminação por agrotóxicos, caso sejam utilizados para controle de pragas.
04) Verdadeira.
As principais etapas que envolvem uma Estação de Tratamento de Água são: a
floculação, a decantação, a filtração e a adição de substâncias como o cloro, o
flúor e a cal virgem.
08) Falsa.
Na época da estiagem, devido à variação do volume de água de um rio, ocorre o
aumento da concentração dos poluentes, o que não favorece o desenvolvimento abundante
de peixes.
16) Verdadeira.
No reaproveitamento das águas poluídas, existe uma solução tecnológica conhecida
como osmose reversa. Trata-se da separação e da depuração das águas com o uso
de uma membrana que retém as impurezas.
33) A
combustão do etanol (C2H6O) e da gasolina (C8H18)
em um determinado carro popular flex
gera quantidades diferentes de CO2, conforme ilustra o quadro
abaixo.
Supondo
que esse carro consiga percorrer 15 km com um litro de gasolina e que esse
mesmo carro, quando abastecido com etanol, consiga percorrer 70% da distância
percorrida com gasolina, assinale o que for correto.
01) Verdadeira.
1L de etanol -------------------- percorre 10,5 Km
5L de etanol -------------------- X
X = percorre 52,5 Km
02) Verdadeira.
1L de etanol -------------------- percorre 10,5 Km
X ---------------------------- percorre 1 Km
X = 0,095L de etanol
1L de etanol --------------------- libera 1,5 Kg de gás carbônico = 1500g de gás carbônico
0,095L de etanol ------------------ X
X = 142,5g de gás carbônico
04) Falsa.
1L de gasolina ----------------------- percorre 15 Km
X ----------------------------------- percorre 1 Km
X = 0,067L de gasolina
1L de gasolina ----------------------- libera 2,4 Kg de gás carbônico = 2400g de gás carbônico
0,067L de gasolina ------------------- X
X = 160,8 g
160,8g -----------------------------100%
142,5g ------------------------------ X
X = 88,6%
08) Falsa.
O etanol é álcool e a gasolina é hidrocarboneto.
16) Verdadeira.
A combustão completa de combustível orgânico produz gás carbônico e água.
34) Considerando
os conceitos de geometria molecular e que todas as figuras geométricas
apresentadas nas alternativas abaixo são regulares, assinale o que for correto.
01) Verdadeira.
Soma = 4 . área do triangulo equilátero de lado a
02) Falsa.
04) Falsa.
08) Verdadeira.
A geometria da molécula de pentacloreto de fósforo é hexaédrica ou bipirâmide trigonal.
16) Falsa.
O ângulo entre as ligações B-F na figura geométrica formada pela molécula de BF3
é aproximadamente 120 graus.
36) Pretende-se
depositar, por meio da eletrólise, 117,4 g de níquel sobre a superfície de uma
peça metálica. Empregam-se, no processo de eletrólise, uma diferença de
potencial e uma corrente elétrica de, respectivamente, 220 V e 193 A. Sabendo
que são envolvidos 2 mols de
elétrons
na deposição do níquel sobre a peça, considere a constante de Faraday como
96.500 C/mol e assinale o que for correto.
01) Falsa.
m = (M/carga).i.t/96500
A massa de níquel depositada na peça metálica é diretamente proporcional ao produto da corrente elétrica pelo tempo na eletrólise.
02) Verdadeira.
2, 96500C de carga -------------------------------------- depositam 59g de níquel
Q -------------------------------------------------------- depositam 117,4g de níquel
Q = 384037C de carga
Durante a deposição do níquel sobre a peça metálica, flui uma carga de
aproximadamente 3,84 x 105 C no circuito da eletrólise.
04) Verdadeira.
Considerando que o tempo necessário para completar o processo de deposição do
níquel sobre a peça metálica é de 2000 s, há um custo energético aproximado de
23,6 kWh nesse processo.
08) Falsa.
A potência elétrica dissipada no processo é de aproximadamente 4,2 x 104
W.
16) Verdadeira.
A massa de níquel depositada na peça durante a eletrólise é proporcional à
massa molar do níquel.
37) Assinale
o que for correto.
01) Verdadeira.
A menor temperatura de um corpo é aproximadamente -273 °C, e
essa temperatura pode ser denominada como a temperatura de zero absoluto.
02) Falsa.
A água pura apresenta uma anomalia em sua dilatação, pois durante um aumento de
temperatura, partindo-se de 0 °C, o seu volume diminui até 4 °C. Portanto, para
uma massa fixa de água, em 4 °C, sua densidade é a máxima possível.
04) Falsa.
A energia cinética média das moléculas de um gás na temperatura absoluta T é
igual a 3 nRT/2 , sendo R a constante dos gases ideais.
08) Verdadeira.
da/db = Ma/Mb
da/3da = 16/Mb
Mb = 48
A massa molecular de um determinado gás ideal A é 16 u. Um outro gás ideal B,
que possua densidade igual a 3 vezes a densidade do gás A, tem, portanto, uma
massa molecular de 48 u, nas mesmas condições de pressão e temperatura.
16) Falsa.
Em uma transformação isotérmica gasosa, pressão e volume são inversamente proporcionais.